การตรวจหาแอคทิวิทีของเอนไซม์เพอร์ออกซิเดสในผลเงาะ
Main Article Content
Abstract
Sombat Kongwithtaya, Arisara Orakul, Benjawan Chochu,Panita Wongcom, Chaiyasad Kachensuwan, Somkiat Phornphisutthimas and Surasak Laloknam
รับบทความ: 12 มีนาคม 2553; ยอมรับตีพิมพ์: 12 พฤษภาคม 2553
บทคัดย่อ
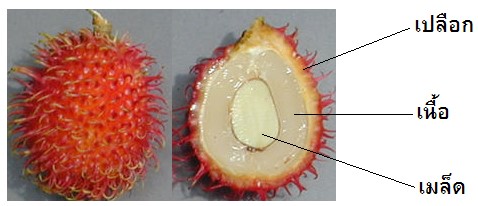
การวิจัยนี้มีวัตถุประสงค์เพื่อตรวจหาแหล่งที่ให้เอนไซม์เพอร์ออกซิเดสในผลเงาะ ได้แก่ เปลือก เนื้อ และเมล็ด โดยการนำตัวอย่างสกัดเอนไซม์โดยใช้สารละลายบัฟเฟอร์ฟอสเฟต พีเอช 7.0 และติดตามแอคทิวิตีของเอนไซม์เพอร์ออกซิเดสด้วย 4-อะมิโนแอนทิไพรีน ฟีนอล และไฮโดรเจนเพอร์ออกไซด์ ทำการบ่มที่อุณหภูมิ 30oซ เป็นเวลา 10 นาที พบว่า ทุกส่วนของผลเงาะมีแอคทิวิทีของเพอร์ออกซิเดส สารสกัดหยาบจากเมล็ดให้แอคทิวิทีของเพอร์ออกซิเดสสูงสุดเท่ากับ 234.52 ยูนิตต่อมิลลิกรัมโปรตีน ตามด้วยส่วนของเปลือกและเนื้อ ให้แอคทิวิทีของเพอร์ออกซิเดสสูงสุดเท่ากับ 206.37 และ 148.26 ยูนิตต่อมิลลิกรัมโปรตีนตามลำดับ จากนั้นนำสารสกัดหยาบจากเงาะทั้ง 3 ส่วน หาค่าความเป็นกรด-เบสและอุณหภูมิที่เหมาะสมในการเร่งปฏิกิริยาของเพอร์ออกซิเดส พบว่า พีเอชและอุณหภูมิที่เหมาะสมของส่วนเมล็ด เท่ากับ 8.5 และ 45oซ ส่วนเนื้อ เท่ากับ 8.5 และ 45oซ และส่วนเปลือก 5.5 และ 45oซ ตามลำดับ จากผลการศึกษาอธิบายได้ว่าทุกส่วนของเงาะมีแอคทิวิทีของเพอร์ออกซิเดสและมีสมบัติแตกต่างกัน
คำสำคัญ: เพอร์ออกซิเดส เงาะ อุณหภูมิ และพีเอชเหมาะสม
Abstract
This research aimed to detect the peroxidase sources from rambutan fruit part, peel, white edible flesh, and seed. The samples were extracted by using phosphate buffer, pH. 7.0. The extracts were measured the peroxidase activity using a mixture of 4-aminoantipyrine, phenol and hydrogen peroxide and incubated at 30oC for 10 minutes. The result showed that all crude extracts from rambutan fruit had the peroxidase activity. The seed crude extract showed the highest peroxidase activity, 234.52 units/mg protein. The white edible flesh and peel crude extracts had peroxidase activity as 206.37 and 148.26 units/mg protein, respectively. The optimum temperature and pH of all crude extracts were also determined. The optimum pH and temperature of peroxidase of crude extracts from seed were 8.5 and 45oC, from white edible flesh were 8.5 and 45oC, and from peel were 8.5 and 45oC, respectively. These results suggested that all parts of rambutant fruit had peroxidase activity, but the kinds of peroxidase are different.
Keywords: Peroxidase, Rambutan, Optimum temperature, Optimum pH
Downloads
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
References
ชะอรทิพย์ แย้มด้วง สมบัติ คงวิทยา สมเกียรติ พรพิสุทธิมาศ และสุรศักดิ์ ละลอกน้ำ. (2553). การศึกษาสมบัติของเอนไซม์เพอร์ออกซิเดสบริสุทธิ์บางส่วนจากกะหล่ำปลี. วารสารหน่วยวิจัยวิทยาศาสตร์ เทคโนโลยี และสิ่งแวดล้อมเพื่อการเรียนรู้ 1(1): 28–34.
ชื่นสุมณ ยิ้มถิ่น. (2548). การกำจัดสารประกอบฟีนอลโดยเปอร์ออกซิเดสที่ได้จากวัสดุเหลือทิ้งทางการเกษตร. วิทยานิพนธ์ วท.ม. (ปิโตรเคมีและวิทยาศาสตร์พอลิเมอร์). กรุงเทพฯ: บัณฑิตวิทยาลัย จุฬาลงกรณ์มหาวิทยาลัย.
ฐากรณ์ สอนวัฒนา. (2544). ลักษณะสมบัติของเปอร์ออกซิเดสในหัวมันสำปะหลัง Manihot esculenta Crantz หลังการเก็บเกี่ยว. วิทยาศาสตรมหาบัณฑิต (สาขาวิชาเทคโนโลยีชีวภาพ). กรุงเทพฯ: บัณฑิตวิทยาลัย จุฬาลงกรณ์มหาวิทยาลัย.
พัชรากร รัตนภูมี. (2542). เอนไซม์เปอร์ออกซิเดสในใบยางพารา. วิทยานิพนธ์ วท.ม. (ชีวเคมี). สงขลา: บัณฑิตวิทยาลัย มหาวิทยาลัยสงขลานครินทร์.
Aberti, N. B. and Klibanov, A. M. (1981). Enzymatic Removal of Dissolved Aromatics from Industrial Aqueous Effuent. Biotechnol. Bioeng. 11: 373–390.
Agostini, E., Medina, M. J., Silvia, R., Forchetti, M. D., and Tigier, H. (1997). Properties of anionic peroxiase isoenzymes from turnip (Brassica napus L.) roots. J. Agric. Food Chem. 45: 596–598.
Alpeeva, I. S., Niculescu-Nister, M., Leon, J. C., Csoregi, E. and Sakharov, I. Y. (2005). Palm tree peroxidase-based biosensor with unique charac-teristics for hydrogen peroxide monitoring. Biosens. Bioelect. 21: 742–748.
Bradford, M. (1976). A rapid method for the quantify-cation of microgram quantities of proteins utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248–254.
Cavalier-Smith, T. (2004). Only six kingdoms of life. Proc. Biol. Sci. 271: 1251–1262.
Civello, P. M., Martinez, G. A., Chaves, A. R., and Anon, M. C. (1995). Peroxidase from strawberry fruit (Fragaria ananassa Duch): partial purification and determination of some properties. J. Agric. Food Chem. 43: 2596– 601.
Dunford, H.B. (1999). Heme peroxidase nomenclature. Plant Peroxidase Newsl. 13: 65–71.
Flock, C., Bassi, A., and Gijzen, M. (1999). Removal of Aqueous Phenol and 2-Chlorophenol with Purified Soybean Peroxidase and Raw Soybean Hulls. J. Chem. Technol. Biotechnol. 74: 303–309.
Gaspar, S., Popescu, I. C., Gazaryan, I. G., Bautista, G., Ardila, G., Sakharov, I. Y., Mattiasson, B., and Csoregi, E. (2000). Biosensor based on novel plant peroxidases: a comparative study. Electrochem. Acta 46: pp. 255–264.
Habetha, M. and Bosch, T. C. (2005). Symbiotic Hydra express a plant-like peroxidase gene during oogenesis. J. Exp. Biol. 208 (Pt 11): 2157–2165.
Hammerschmidt, R., Nuckles, E. M., and Kuc, J. (1982). Association of enhanced peroxidase activity with induced systemic resistance of cucumber to Colletotrichum lagenarium. Physiol. Plant Pathol. 20: 73–82.
Ito, H., Hiraoka, N., Ohbayashi, A., and Ohashi, Y. (1991). Purification and chracterization of rice peroxidases. Agric. Biol. Chem. 55: 2445–2454.
Jen, J. J., Seo, A., and Flurkey, W. H. (1980). Tomato peroxidase: purification via hydrophobic chromatography. J. Food Sci. 45: 60–63.
Kamuf, W., Nixon, A., Parker, O., and Barnum, G. C. (2003). Overview of Caramel Colors. Cereal Foods World 42(2): 64–69. Available at: http://www. aaccnet.org/cerealfoodsworld/pdfs/W03-0205-01F.pdf
Kim, Y. H., and Yoo, J. J. (1996). Peroxidase production from carrot hairy root cell culture. Enzyme Microb. Technol. 18: 531–535.
Kongvithtaya, S., Laloknam, S., and Chairote, G. (2010). Characterization of ammonium precipitatant peroxidase from Ivy gourd. Pure and Applied Chemistry International Conference 2010, Ubol Ratchathani University, Ubol Ratchathani.
Mujer, C. V., Mendoza, E. M. T., and Ramirez, D. A. (1983). Coconut peroxidase isoenzymes: isolation, partial purification and physiochemical properties. Phytochem. 22: 1335–1340.
O’Brien P. (2000). Peroxidase. Chemico-Biological interactions. 129: 113–139.
Richard-Forget, F.C. and Gauillard, F.A. (1997). Oxidation of chlorogenic acid, catechins and 4-methylcatechol in model solutions by combinations of pear (Pyrus communis Cv Williams) polyphenol oxidase and peroxidase: A possible involvement of peroxidase in enzymatic browning. J. Agric. Food Chem. 45: 2472–2476.
Riquelme, A., and Cardemil, L. (1993). Peroxidases in the cell-walls of seeds and seedlings of Araucaria araugana. Phytochem. 31: 15–20.
Saitou, T., Kamada, H., and Harada, H. (1991). Iso-peroxidase in hairy roots and regenerated plants of horse radish (Armoracia lapathifolia). Plant Sci. 75: 195–201.
Sessa, D. J., and Anderson, R. L. (1981). Soybean peroxidase: purification and some properties. J. Agric. Food Chem. 29: 960–965.
Triplett, B. and Mellon, J. E. (1992). Purification and characterization of anionic peroxidases from cotton (Gossypium hirsutum L.). Plant Sci. 81: 147–154.
Vamos-Vigyazo, L. (1981). Polyphenol oxidase and peroxidase in fruits and vegetables. Crit. Rev. Food Sci. Nutri. 15: 49–127.
Vernwal S., Yadav R., and Yadav K. (2006). Purification of peroxidase from Solanum melongena fruit juice. Indian J. Biochem. Biophys. 43: 239–243.
Welinder, K.G. (1992). Superfamily of plant, fungal and bacterial peroxidases, Curr. Opin. Struct. Biol. 2: 388–393.
Weng, Z., Handrick, X. M., and Maesmans, G. (1991). Immobilized peroxidase: a potential bioindicator for evaluation of thermal process. J. Food Sci. 56: 567–750.
Wright, H., and Nicell, J. A. (1999). Characterization of soybean peroxidase for the treatment of aqueous phenol. Biores. Technol. 70: 69–79.
Wu, Y., Taylor, K. E., Biswas, N., and Bewtra, J.K. (1999). Kinetic model aided reactor design for peroxidase-catalysed removal of phenol in the presence of polyethylene glycol. J. Chem. Technol. Biotechnol. 74: 519–526.
Yamada, Y., Kobayashi, S., Watanabe, K. Q., and Hayashi, U. (1987). Production of horse radish peroxidase by plant cell culture. J. Chem. Tech. Biotechnol. 38: 31–39.
Zamocky, M. (2004). Phylogenetic relationships in class I of the superfamily of bacterial, fungal, and plant peroxidases. Eur. J. Biochem. 271: 3297–3309.