พอลิไฮดรอกซีอัลคาโนเอต: วัสดุชีวภาพทางเลือกทดแทนพลาสติก
Main Article Content
Abstract
Chanchanok Duangsri and Wuttinun Raksajit
รับบทความ: 6 กันยายน 2559; ยอมรับตีพิมพ์: 11 พฤศจิกายน 2559
บทคัดย่อ
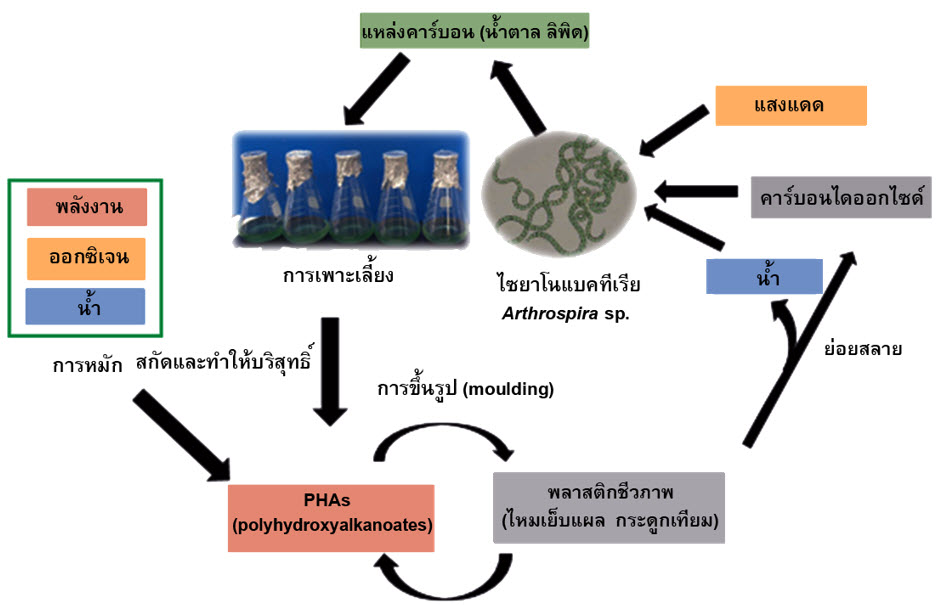
พลาสติกปิโตรเคมีที่ไม่ย่อยสลายจะสะสมอยู่ในสิ่งแวดล้อมซึ่งก่อให้เกิดปัญหาเพิ่มขึ้นตามมา พลาสติกที่ย่อยสลายได้ เช่น พอลิไฮดรอกซีอัลคาโนเอต (PHAs) จึงได้รับการพัฒนาขึ้นเพื่อใช้เป็นวัสดุ ทางเลือกมาทดแทนและลดการใช้พลาสติกปิโตรเคมี PHAs เป็นพอลิเอสเทอร์สายตรงที่ผลิตขึ้นจากจุลินทรีย์หลากหลายสายพันธุ์ ความยืดหยุ่นและความเหนียวขึ้นอยู่กับโครงสร้างของ PHAs แต่ละชนิด PHAs สามารถย่อยสลายได้อย่างสมบูรณ์ในสิ่งแวดล้อม นอกจากนี้ PHAs ยังได้รับการพิสูจน์ว่ามีสมบัติที่เข้ากันได้ทางชีวภาพโดยไม่มีความเป็นพิษในเซลล์สัตว์ PHAs สังเคราะห์จากแอคติวิตีของกลุ่มเอนไซม์ซึ่งถูกแปลรหัสจากกลุ่มยีน phaABC โดย PHA synthase เป็นเอนไซม์หลักในวิถีชีวสังเคราะห์ PHAs ดังนั้นการคัดกรองจุลินทรีย์หรือสร้างจุลินทรีย์สายพันธุ์ใหม่ที่มีศักยภาพในการผลิตและสะสม PHAs ภายในเซลล์สูง จึงมีความสำคัญต่อการพัฒนาผลิตวัสดุทางเลือกเชิงพาณิชย์ในอนาคต บทความนี้กล่าวถึงข้อมูลพื้นฐานของพอลิไฮดรอกซีอัลคาโนเอต สมบัติ ประโยชน์ และการประยุกต์ใช้
คำสำคัญ: พอลิไฮดรอกซีอัลคาโนเอต พลาสติกชีวภาพ สมบัติเข้ากันได้ทางชีวภาพ วิถีชีวสังเคราะห์ PHAs
Abstract
Currently, the non-degradable petrochemical plastics accumulated in the environment are concerned problem. Biodegradable plastics, such as polyhydroxyalkanoates (PHAs), have been developed for use as alternative materials to replace and reduce the using of petro-chemicals plastics. PHAs are linear polyester produced by different microbial strains. The flexibility and toughness of PHAs depends on their formulations. PHAs are environmental biodegradable polymers. In addition, PHAs have been proved biocompatible, which means they have no toxic effects on animal cells. PHAs are synthesized from the activities of enzymes, which are encoded from the phaABC genes. PHA synthases are the key enzymes of PHAs biosynthesis. Therefore, screening of microorganisms or microbial strains that have the potential to produce PHAs and accumulate within cells are significant for alternative material development produced commercially in the future. This short article attempts to provide background on the polyhydroxyalkanoates, properties, versatility and their applications.
Keywords: Polyhydroxyalkanoates, Bioplastic, Biocompatibility, PHAs biosynthesis pathway
Downloads
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
References
Anjum, A., Zuber, M., Zia, K. M., Noreen, A., Anjum, M. N., and Tabasum, S. (2016). Microbial production of polyhydroxyalka noates (PHAs) and its copolymers: A review of recent advancements. International Journal of Biological Macromolecules 89: 161–174.
Bhati, R., Samantaray, S., Sharma, L., and Mallick, N. (2010). Poly-beta-hydroxybutyrate accumulation in cyanobacteria under photo-autotrophy. Biotechnology Journal 5(11): 1181–1185.
Daranarong, D., Chan, R. T. H., Wanandy, N. S., Molloy, R., Punyodom, W., and Foster, L. J. R. (2014). Electrospun polyhydroxy butyrate and poly(L-lactide-co-ε-capro lactone) composites as nanofibrous scaffolds BioMed Research International Article ID 741408.
de Morais, M. G., Stillings, C., Dersch, R., Ru-disile, M., Pranke, P., Costa, J. A. V., and Wendorff, J. (2015). Extraction of poly(3-hydroxybutyrate) from Spirulina LEB 18 for developing nanofibers. Polimeros 25(2): 161–167.
Díaz-Barrera, A., Andler, R., Martínez, I., and Peña, C. (2016). Poly-3-hydroxybutyrate production by Azotobacter vinelandii strains in batch cultures at different oxygen transfer rates. Journal of Chemical Technology and Biotechnology 91:1063–1071.
Drosg, B., Fritz, I., Gattermayr, F., and Silvestrini, L. (2015). Photo-autotrophic production of poly(hydroxyalkanoates) in cyanobacteria. Chemical and Biochemical Engineering Quarterly 29(2): 145–156.
Gumel, A. M., Annuar, M. S. M., and Chisti, Y. (2013). Recent advances in the produc-tion, recovery and applications of polyhy-droxyalkanoates. Journal of Polymers and the Environment 21(2):589–605.
Hondo, S., Takahashi, M., Osanai, T., Matsuda, M., Hasunuma, T., Tazuke, A., Nakahira, Y., Chohnan, S., Hasegawa, M., and Asayama, M. (2015). Genetic engineering and metabolite profiling for overproduction of polyhydroxybutyrate in cyanobac-teria. Journal of Bioscience and Bioengineering 120(5): 510–517.
Janssen, P. J., Morin, N., Mergeay, M., Leroy, B., Wattiez, R., Vallaeys, T., Waleron, K., Waleron, M., Wilmotte, A., Quillardet, P., Tandeau De Marsac, N., Talla, E., Zhang, C.-C., and Leys, N. (2010). Genome sequence of the edible cyanobacterium Arthrospira sp. PCC 8005. Journal of Bacteriology 192(9): 2465–2466.
Jau, M.-H., Yew, S.-P., Toh, P.S.Y., Chong, A. S. C., Chu, W.-L., Phang, S.-M., Najimudin, N., and Sudesh, K. (2005). Bio-synthesis and mobilization of poly(3-hy-droxybutyrate) [P(3HB)] by Spirulina platensis. International Journal of Biological Macromolecules 36(3):144–151.
Kaewbaingam, A., Incharoensakdi, A., and Monshupanee, T. (2016). Increased accumulation of polyhydroxybutyrate in divergent cyanobacteria under nutrient-deprived photoautotrophy: An efficient conversion of solar energy and carbon dioxide to polyhydroxybutyrate by Calothrixs cytnemicola TISTR 8095. Bioresource Technology 212: 342–347.
Khanna, S., and Srivastava, A. K. (2005). Re-cent advances in microbial polyhydroxy alkanoates. Process Biochemistry 40: 607–619.
Klask, C., Raberg, M., Heinrich, D., and Steinbüchel, A. (2015). Heterologous expression of various PHA synthase genes in Rhodospirillum rubrum. Chemical and Biochemical Engineering Quarterly 29(2): 75–85.
Kozhevnikov, I. V., Volova, T. G., Hai, T., and Steinbüchel, A. (2010). Cloning and molecular organization of the polyhydroxy alkanoic acid synthase gene (phaC) of Ralstonia eutropha strain B5786. Applied Biochemistry and Microbiology 46(2): 140–147.
López, N. I., Pettinari, M. J., Nikel, P. I., and Méndez, B. S. (2015). Polyhydroxyalka noates: Much more than biodegradable Plastics. Advances in Applied Micro-biology 93: 73–106.
Mozejko-Ciesielska, J., and Kiewisz, R. (2016). Bacterial polyhydroxyalkanoates: Still fabulous? Microbiological Research 192: 271–282.
Numata, K., Motoda, Y., Watanabe, S., Osanai, T., and Kigawa, T. (2015). Co-expression of two polyhydroxyalkanoate synthase subunits from Synechocystis sp. PCC 6803 by cell-free synthesis and their specific activity for polymerization of 3-hydroxybutyryl-coenzyme A. Biochemistry 54(6): 1401–1407.
Omar, H. H., Aly, M. M., Al-Malki, W. J., and Balkhair, K. S. (2016). Production and enhancement of poly-beta-hydroxybutyrate in cyanobacteria. Main Group Chemistry 15(2): 153–161.
Panda, B., Sharma, L., and Mallick, N. (2005). Poly-beta-hydroxybutyrate accumulation in Nostoc muscorum and Spirulina platensis under phosphate limitation. Journal of Plant Physiology 162(12):1376–1379.
Riedel, S. L., Jahns, S., Koenig, S., Bock, M. C. E., Brigham, C. J., Bader, J., Stahl, U. (2015). Polyhydroxyalkanoates production with Ralstonia eutropha from low quality waste animal fats. Journal of Biotechnology 214: 119–127.
Shrivastav, A., Mishra, S. K., and Mishra, S. (2010). Polyhydroxyalkanoate (PHA) synthesis by Spirulina subsalsa from Gujarat coast of India. International Journal of Biological Macromolecules 46(2): 255–260.
Sudesh, K., Taguchi, K., and Doi, Y. (2002). Effect of increased PHA synthase activity on polyhydroxyalkanoates biosynthesis in Synechocystis sp. PCC6803. International Journal of Biological Macromolecules 30(2): 97–104.
Tan, G. A., Chen, C.-L., Li, L., Ge, L., Wang, L., Razaad, I. M. N., Li, Y., Zhao, L., Mo, Y., and Wang, J.-Y. (2014). Start a re-search on biopolymer polyhydroxyalka noate (PHA): A review. Polymers 6(3): 706–754.
Taroncher-Oldenburg, G., Nishina, K., and Step-hanopoulos, G. (2000). Identification and analysis of the polyhydroxyalkanoate-specific -ketothiolase and acetoacetyl coenzyme a reductase genes in the cyanobacterium Synechocystis sp. strain PCC 6803. Applied and Environmental Microbiology 66(10): 4440–4448.
Verlinden, R. A. J., Hill, D. J., Kenward, M. A., Williams, C. D., and Radecka, I. (2007). Bacterial synthesis of biodegradable poly hydroxyalkanoates. Journal of Applied Microbiology 102: 1437–1449.
Vincenzini, M., Sili, C., de Philippis, R., Ena, A., and Materassi, R. (1990). Occurrence of poly-beta-hydroxybutyrate in Spirulina species. Journal of Bacteriology 172(5): 2791–2792.