การเพิ่มการผลิตซี–ไฟโคไซยานินและพอลิไฮดรอกซีบิวทิเรตในอาร์โทสไปรา พลาเทนซิส ที่เพาะเลี้ยงด้วยไดโอดเปล่งแสง (แอลอีดี)
Main Article Content
Abstract
Chanchanok Duangsri, Winai Charunchaipipat, Khomson Satchasataporn, Authen Promariya, Nat–Anong Mudtham, Nattaphong Akrimajirachoote, Suchanit Ngamkala and Wuttinun Raksajit
รับบทความ: 6 กุมภาพันธ์ 2565; แก้ไขบทความ: 22 กุมภาพันธ์ 2565; ยอมรับตีพิมพ์: 3 มีนาคม 2565; ตีพิมพ์ออนไลน์: 15 พฤศจิกายน 2565
บทคัดย่อ
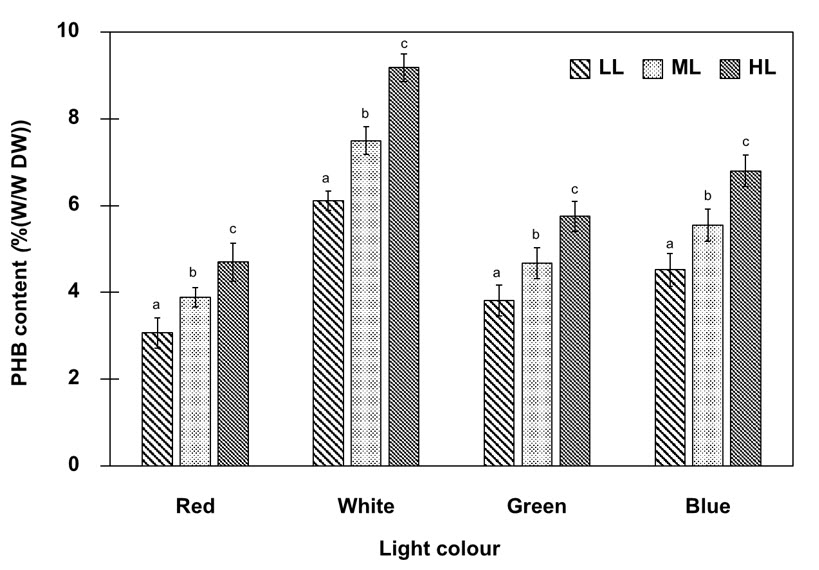
ไซยาโนแบคทีเรียม อาร์โทสไปรา พลาเทนซิส เป็นทรัพยากรที่มีศักยภาพสูงในการผลิตสารประกอบที่มีมูลค่า เช่น ซี–ไฟโคไซยานิน (ซี-พีซี) และ พอลิไฮดรอกซีบิวทีเรต (พีเอชบี) การ ศึกษาครั้งนี้มีวัตถุประสงค์เพื่อประเมินผลกระทบของไดโอดเปล่งแสง (แอลอีดี) (แสงสีแดง สีเขียว สีน้ำเงิน และสีขาว) ภายใต้ความเข้มแสงต่ำ ปานกลางและสูง (LL, ML, HL; 15, 30, 60 ไมโครโมลโฟตอนต่อตารางเมตรต่อวินาที ตามลำดับ) ต่อปริมาณชีวมวล คลอโรฟิลล–เอ ซี–พีซี และพีเอชบีของอาร์โทสไปรา พลาเทนซิส อีกทั้งประเมินแอคติวิตีการกำจัดอนุมูลอิสระของซี–พีซีของอาร์โทสไปรา พลาเทนซิส ผลการศึกษาพบว่า ค่าสูงสุดของปริมาณชีวมวล (2.80 ± 0.11 กรัมต่อลิตร) และปริมาณคลอโรฟิลล์–เอ (5.80 ± 0.12 มิลลิกรัมต่อลิตร) พบในเซลล์ที่เพาะเลี้ยงภายใต้แสงสีแดงที่มีความเข้มแสงปานกลาง ในขณะที่ค่าต่ำสุดของปริมาณชีวมวลและและปริมาณคลอโรฟิลล์–เอ พบในเซลล์ที่เพาะเลี้ยงภายใต้แสงสีน้ำเงินที่มีความเข้มแสงปานกลาง ในทางกลับกัน ซี–พีซี มีปริมาณเพิ่มขึ้นเท่ากับ 2.78 ± 0.07 มิลลิกรัมต่อกรัม ในเซลล์ที่เพาะเลี้ยงภายใต้แสงสีน้ำเงินที่มีความเข้มแสงสูง เมื่อเทียบกับแสงสีแดง สีเขียว และสีขาวที่ความเข้มแสงเดียวกัน นอกจากนี้พบว่า ซี–พีซี ที่ความเข้มข้น 100 ไมโครกรัมต่อมิลลิลิตรซึ่งสกัดได้จากเซลล์ที่เพาะเลี้ยงภายใต้แสงสีน้ำเงินที่มีความเข้มแสงสูง แสดงค่าแอคติวิตีการกำจัดอนุมูลอิสระเท่ากับร้อยละ 52.1 ± 5.6 นอกจากนี้พีเอชบีมีปริมาณสูงสุด (9.18 ± 0.32%(w/w) DW) ในเซลล์ที่เพาะเลี้ยงภายใต้แสงสีขาวที่มีความเข้มแสงสูงและขาดแหล่งอาหารไนโตรเจนในอาหารเลี้ยง เมื่อเทียบกับแสงสีแดง สีเขียว และสีน้ำเงินที่ความเข้มแสงเดียวกัน การศึกษาครั้งนี้ให้ข้อมูลทางสรีรวิทยาที่เป็นประโยชน์เกี่ยวกับผลกระทบของสเปกตรัมแสงที่แตกต่างกันและความเข้มของแสงต่อการเจริญเติบโต ปริมาณรงควัตถุสังเคราะห์ด้วยแสง และพีเอชบี ซึ่งเป็นแนวทางเบื้องต้นในการปรับการผลิตสารประกอบที่มีมูลค่าสูงจากการเพาะเลี้ยงอาร์โทสไปรา พลาเทนซิส ให้เหมาะสม
คำสำคัญ: อาร์โทสไปรา พลาเทนซิส ซี–ไฟโคไซยานิน แอลอีดี พอลิไฮดรอกซีบิวทีเรต
Abstract
The cyanobacterium Arthrospira platensis is considered a highly potential resource for the production of valuable compounds such as C–phycocyanin (C–PC) and poly–3–hydroxybutyrate (PHB). This study aimed to evaluate the effects of different coloured light–emitting diodes (LEDs) (red, green, blue, and white light) under low, medium, and high light intensity (LL, ML, HL; 15, 30, 60 µmol photons m–2s–1, respectively) on the biomass, chlorophyll–a (Chl–a), C–PC, and PHB contents of A. platensis, and further determine the free–radical scavenging activity of A. platensis C–PC. The results exhibited that the highest values for biomass (2.80 ± 0.11 g L–1) and chlorophyll-a (Chl–a) content (5.80 ± 0.12 mg L–1) were obtained in cells cultured under ML red light, while the lowest values for biomass and Chl–a content were observed in cells cultured under ML blue light. On the other hand, the C–PC value increased to 2.78 ± 0.07 mg g–1 in cells cultured under HL blue light compared to red, green, and white lights with equal intensities. Besides, the purified C–PC obtained from cells cultured under HL blue light showed 52.1 ± 5.6% of free–radical scavenging activity at a C–PC concentration of 100 µg mL–1. In addition, the maximum PHB content (9.18 ± 0.32%(w/w) DW) was obtained in cells cultured under HL white light with nitrogen deprivation compared to red, green, and blue lights with equal intensities. The results of the current study provide useful physiological information regarding the effects of different light spectra and light intensity on growth, photosynthetic pigments, and PHB as a prerequisite to optimize the production of high–value compounds from cultures of A. platensis.
Keywords: Arthrospira platensis, C-Phycocyanin, LEDs, Polyhydroxybutyrate
Downloads
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
References
Abiusi, F., Sampietro, G., Marturano, G., Biondi, N., Rodolfi, L., D'Ottavio, M., and Tredici, M. R. (2014). Growth, photosynthetic efficiency, and biochemical compo-sition of Tetraselmis suecica F&M–M33 grown with LEDs of different colors. Biotechnology and Bioengineering 111(5): 956–964.
Ansari, S., and Fatma, T. (2016). Cyanobac-terial polyhydroxybutyrate (PHB): Screening, optimization and characterization. PLoS ONE 11(6): e0158168.
Bennett, A., and Bogorad, L. (1973). Complementary chromatic adaptation in a filamentous blue–green alga. Journal of Cell Biology 58(2): 419–435.
Campos Assumpção de Amarante, M., Cavalcante Braga, A.R., Sala, L., and Juliano Kalil, S. (2020). Colour stability and antioxidant activity of C–phycocyanin–added ice creams after in vitro digestion. Food Research International 137: 109602.
Charunchaipipat, W., Mudtham, N.–A., Promariya, A., Duangsri, C., Satchasataporn, K., Ngamkala, S., and Raksajit, W. (2020). Effect of butyrate supplementation on the production of a high value C–phycocyanin and polyhydroxybutyrate in Spiru-lina platensis. Journal of Research Unit on Science, Technology and Environ-ment for Learning 11(2): 369–379. (in Thai)
Chen, H.–B., Wu, J.–Y., Wang, C.–F., Fu, C.–C., Shieh, C.–J., Chen, C.–I., Wang, C.–Y., and Liu, Y.–C. (2010). Modeling on chlorophyll a and phycocyanin production by Spirulina platensis under various light–emitting diodes. Biochemical Engineer-ing Journal 53(1): 52–56.
Costa, S. S., Miranda, A. L., Andrade, B. B., Assis, D. D. J., Souza, C. O., de Morais, M. G., Costa, J. A. V., and Druzian, J. I. (2018). Influence of nitrogen on growth, biomass composition, production, and properties of polyhydroxyalkanoates (PHAs) by microalgae. International Journal of Biological Macromolecules 116: 552–562.
da Fontoura Prates, D., Duarte, J. H., Ven-druscolo, R. G., Wagner, R., Ballus, C. A., da Silva Oliveira, W., Godoy, H. T., Barcia, M. T., de Morais, M. G., Radmann, E. M., and Costa, J. A. V. (2020). Role of light emitting diode (LED) wavelengths on increase of protein productivity and free amino acid profile of Spirulina sp. cultures. Bioresource Technology 306: 123184.
de Philippis, R., Sili, C., and Vincenzini, M. (1992). Glycogen and poly–β–hydroxylbutyrate synthesis in Spirulina maxima. Journal of General Microbiology 138(8): 1623–1628.
Duangsri, C., Mudtham, N.–A., Incharoensakdi, A., and Raksajit, W. (2020). Enhanced polyhydroxybutyrate (PHB) accumulation in heterotrophically grown Arthrospira platensis under nitrogen deprivation. Journal of Applied Phycology 32(6): 3645–3654.
García, A. B., Longo, E., and Bermejo, R. (2021). The application of a phycocyanin extract obtained from Arthrospira platensis as a blue natural colorant in beverages. Journal of Applied Phycology 33(5): 3059–3070.
Gim, G. H., Ryu, J., Kim, M. J., Kim, P. I., and Kim, S. W. (2016). Effects of carbon source and light intensity on the growth and total lipid production of three microalgae under different culture conditions. Journal of Industrial Microbiology and Biotechnology 43(5): 605–616.
Khatoon, H., Kok Leong, L., Abdu Rahman, N., Mian, S., Begum, H., Banerjee, S., and Endut, A. (2018). Effects of different light source and media on growth and production of phycobiliprotein from freshwater cyanobacteria. Bioresource Technology 249: 652–658.
Klepacz–Smółka, A., Pietrzyk, D., Szeląg, R., Głuszcz, P., Daroch, M., Tang, J., and Ledakowicz, S. (2020). Effect of light colour and photoperiod on biomass growth and phycocyanin production by Synechococ-cus PCC 6715. Bioresource Technology 313: 123700.
Kumar, D., Wattal Dhar, D., and Pabbi, S. (2014). Extraction and purification of C–phycocyanin from Spirulina platensis (CCC 540). Indian Journal of Plant Physiology 19(2): 184–188.
Luimstra, V. M., Schuurmans, J. M., Verschoor, A. M., Hellingwerf, K. J., Huisman, J., and Matthijs, H. C. P. (2018). Blue light reduces photosynthetic efficiency of cyanobacteria through an imbalance between photosystems I and II. Photosynthesis Research 138(2): 177–189.
Lupatini, A. L., Colla, L. M., Canan, C., Colla, E. (2017). Potential application of microalga Spirulina platensis as a protein source. Journal of the Science of Food and Agriculture 97(3): 724–732.
MacKinney, G. (1941). Absorption of light by chlorophyll solutions. Journal of Biochemical Chemistry 140: 315–322.
Madhyastha, H. K., and Vatsala, T. M. (2007). Pigment production in Spirulina fussiformis in different photophysical conditions. Biomolecular Engineering 24(3): 301–305.
Maltsev, Y., Maltseva, K., Kulikovskiy, M., Maltseva, S. (2021). Influence of light conditions on microalgae growth and content of lipids, carotenoids, and fatty acid composition. Biology 10(10): 1060.
Markou, G. (2014). Effect of various colors of light–emitting diodes (LEDs) on the biomass composition of Arthrospira platensis cultivated in semi–continuous mode. Applied Biochemistry and Biotechnology 172(5): 2758–2768.
McGee, D., Archer, L., Fleming, G. T. A., Gillespie, E., and Touzet, N. (2020). Influence of spectral intensity and quality of LED lighting on photoacclimation, carbon allocation and high–value pigments in micro-algae. Photosynthesis Research 143(1): 67–80.
Milia, M., Corrias, F., Addis, P., Zitelli, G. C., Cicchi, B., Torzillo, G., Andreotti, V., and Angioni, A. (2022). Influence of different light sources on the biochemical composition of Arthrospira spp. grown in model systems. Foods 11(3): 399.
Minic, S., Radomirovic, M., Savkovic, N., Ra-dibratovic, M., Mihailovic, J., Vasovic, T., Nikolic, M., Milcic, M., Stanic–Vucinic, D., and Cirkovic Velickovic, T. (2018). Covalent binding of food–derived blue pigment phycocyanobilin to bovine β–lactoglobulin under physiological conditions. Food Chemistry 269: 43–52.
Mogany, T., Kumari, S., Swalaha, F.M., and Bux, F. (2020). An in silico structural and physiochemical analysis of C–phycocyanin of halophile Euhalothece sp. Algal Research 51:102025.
Monshupanee, T., and Incharoensakdi, A. (2014). Enhanced accumulation of glycogen, lipids and polyhydroxybutyrate under optimal nutrients and light intensities in the cyanobacterium Synechocystis sp. PCC 6803. Journal of Applied Microbiology 116(4): 830–838.
Moradi, Z., Madadkar Haghjou, M., Zarei, M., Colville, L., and Raza, A. (2021). Synergy of production of value–added bioplastic, astaxanthin and phycobilin co–products and direct green 6 textile dye remediation in Spirulina platensis. Chemosphere 280: 130920.
Nematollahi, M. A., Laird, D. W., Hughes, L. J., Raeisossadati, M., Moheimani, N. R. (2020). Effect of organic carbon source and nutrient depletion on the simultaneous production of a high value bioplastic and a specialty pigment by Arthrospira platensis. Algal Research 47: 101844.
Panda, B., and Mallick, N. (2007). Enhanced poly–β–hydroxybutyrate accumulation in a unicellular cyanobacterium, Synechocystis sp. PCC 6803. Letters in Applied Microbiology 44(2): 194–198.
Pan–utai, W., and Iamtham, S. (2019). Extraction, purification and antioxidant activity of phycobiliprotein from Arthrospira platensis. Process Biochemistry 82: 189–198.
Patel, A., Mishra, S., Pawar, R., and Ghosh, P. K. (2005). Purification and characterization of C–phycocyanin from cyanobacterial species of marine and freshwater habitat. Protein Expression and Purification 40(2): 248–255.
Patel, H. M., Rastogi, R. P., Trivedi, U., and Madamwar, D. (2018). Structural characterization and antioxidant potential of phycocyanin from the cyanobacterium Geitlerinema sp. H8DM. Algal Research 32: 372–383.
Prasanna, R., Sood, A., Jaiswal, P., Nayak, S., Gupta, V., Chaudhary, V., Joshi, M., and Natarajan, C. (2010). Rediscovering cyanobacteria as valuable sources of bioactive compounds (Review). Applied Biochemistry and Microbiology 46(2): 119–134.
Renugadevi, K., Valli Nachiyar, C., Sowmiya, P., and Sunkar, S. (2018). Antioxidant activity of phycocyanin pigment extracted from marine filamentous cyanobacteria Geitlerinema sp. TRV57. Biocatalysis and Agricultural Biotechnology 16: 237–242.
Roy, D., and Pabbi, S. (2022). A simple improved protocol for purification of C–phycocyanin from overproducing cyanobacteria and its characterization. Journal of Applied Phycology. DOI: 10.1007/s10811- 021-02649-z.
Sonani, R. R., Patel, S., Bhastana, B., Jakharia, K., Chaubey, M. G., Singh, N. K., and Madamwar, D. (2017). Purification and antioxidant activity of phycocyanin from Synechococcus sp. R42DM isolated from industrially polluted site. Bioresource Technology 245: 325-331.
van Hieu, H., Quang–Tuong, L., and Cong Doan, B. (2021). The production of high phycocyanin by applications of red light–emitting diodes (LEDs) in vitro algae growth on Spirulina platensis. Journal of Nano– and Electronic Physics 13(3): 1–4.
Wang, C.–Y., Fu, C.–C., and Liu, Y. –C. (2007). Effects of using light–emitting diodes on the cultivation of Spirulina platensis. Biochemical Engineering Journal 37(1): 21–25.
Warner, M. E., and Madden, M. L. (2007). The impact of shifts to elevated irradiance on the growth and photochemical activity of the harmful algae Chattonella subsalsa and Prorocentrum minimum from Delaware. Harmful Algae 6(3): 332–342.
Wicaksono, H. A., Satyantini, W. H., and Masithah, E.D. (2019). The spectrum of light and nutrients required to increase the production of phycocyanin Spirulina platensis. IOP Conference Series: Earth and Environmental Science 236(1): 012008.