กิจกรรมการต้านจุลินทรีย์ก่อโรคและการยับยั้งการสร้างไบโอฟิล์มของสารสกัดจากเปลือกลำต้นกัญชง
Main Article Content
Abstract
Ratchanu Meidong, Saowanit Tongpim, Jaran Prajanban, Ratsupa Thammaporn, Kasem Kongnirundonsuk, Pilanthana Lertsatitthanakorn and Siriporn Tipsing
รับบทความ: 14 สิงหาคม 2563; แก้ไขบทความ: 21 พฤศจิกายน 2563; ยอมรับตีพิมพ์: 7 ธันวาคม 2563; ตีพิมพ์ออนไลน์: 1 มิถุนายน 2564
บทคัดย่อ
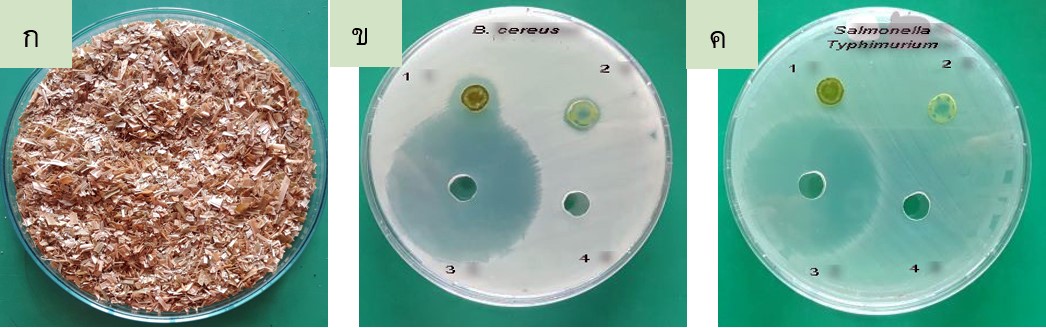
การเพิ่มขึ้นของแบคทีเรียที่ดื้อยาปฏิชีวนะส่งผลเสียร้ายแรงต่อสุขภาพของมนุษย์ การศึกษาค้นคว้าหาสารจากธรรมชาติมาใช้ยับยั้งเชื้อดื้อยาจึงมีความสำคัญ ในงานวิจัยนี้มีวัตถุประสงค์เพื่อศึกษาศักยภาพของเปลือกลำต้นกัญชง (Cannabis sativa L.) ในการยับยั้งการเจริญและการสร้าง ไบโอฟิล์มของจุลินทรีย์ก่อโรค ผลการทดลองพบว่าสารสกัดหยาบจากเปลือกลำต้นกัญชงสามารถยับยั้งการเจริญของเชื้อทดสอบ ได้แก่ Bacillus cereus, Staphylococcus aureus, methicillin–resistant S. aureus, Escherichia coli, Pseudomonas aeruginosa, Salmonella enterica serovar Typhimurium, Salmonella enterica serovar Typhi, Serratia marcescens และ Candida albicans ผลที่น่าสนใจคือสารสกัดดังกล่าวไม่ยับยั้งการเจริญของแบคทีเรียโพรไบโอติกส์กลุ่ม Lactobacillus spp. โดยในกลุ่มจุลินทรีย์ที่ใช้ทดสอบพบว่าสารสกัดหยาบจากเปลือกลำต้นกัญชงสามารถยับยั้ง B. cereus และ Salmonella Typhimurium ได้สูงสุด เมื่อศึกษาค่าความเข้มข้นต่ำสุดที่ยับยั้งเชื้อได้ (minimum inhibitory concentration: MIC) พบว่ามีค่า MIC ของสารสกัดจากเปลือกลำต้นกัญชงต่อแบคทีเรีย B. cereus และ Salmonella Typhimurium คือ ความเข้มข้น 0.625 และ 1.25 mg/mL ตามลำดับ เมื่อทดสอบค่าความเข้มข้นต่ำสุดของสารสกัดจากเปลือกลำต้นกัญชงที่ฆ่าเชื้อได้ (minimum bactericidal concentration: MBC) พบว่า สารสกัดมีค่า MBC ต่อแบคทีเรีย B. cereus และ Salmonella Typhimurium ที่ความเข้มข้น 1.25 และ 2.50 mg/mL ตามลำดับ นอกจากนี้ยังศึกษาความสามารถของสารสกัดจากเปลือกลำต้นกัญชงต่อการยับยั้งการสร้างไบโอฟิล์มของแบคทีเรีย ผลการทดสอบพบว่าสารสกัดนี้สามารถลดการสร้างไบโอฟิล์มของแบคทีเรีย B. cereus และ Salmonella Typhimurium ได้ร้อยละ 70.63 และร้อยละ 63.79 ตามลำดับ ผลจากการศึกษานี้แสดงให้เห็นถึงศักยภาพของสารสกัดจากเปลือกลำต้นกัญชงในการใช้เป็นสารชีวภาพในการต้านจุลินทรีย์
คำสำคัญ: เฮมพ์ โพรไบโอติกส์ เชื้อก่อโรค ไบโอฟิล์ม
Abstract
The emergence of drug–resistant bacteria poses a serious threat to human health. Therefore, investigation of new natural substances for treating drug–resistant bacteria is im-portant. This study aimed to investigate the potential use of hemp (Cannabis sativa L.) bark extract to inhibit growth and biofilm formation of some pathogens. It was found that the crude extract of hemp bark could inhibit growth of tested microbes including Bacillus cereus, Staphylococcus aureus, methicillin–resistant S. aureus, Escherichia coli, Pseudomonas aeruginosa, Salmonella enterica serovar Typhimurium, S. enterica serovar Typhi, Serratia marcescens and Candida albicans. Interestingly, the hemp bark extract showed no inhibitory effects on growth of probiotic Lactobacillus spp. Among the microorganisms tested, the hemp bark extract displayed the highest inhibitory effects on the growth of B. cereus and Salmonella Typhimurium. Therefore, the minimum inhibitory concentration (MIC) was further determined which resulted that the MIC of hemp bark extract against B. cereus and Salmonella Typhimurium were 0.625 and 1.25 mg/mL, respectively. In addition, the minimum bactericidal concentration (MBC) of hemp bark extract was also examined which resulted that the MBC of hemp bark extract against B. cereus and Salmonella Typhimurium were 1.25 and 2.50 mg/mL, respectively. The ability of hemp bark extract to inhibit bacterial biofilm formation was also investigated. It was found that the extract could reduce biofilm formation of B. cereus and Salmonella Typhimurium by 70.03% and 63.79%, respectively. The results from this study demonstrated the good potential of hemp bark extract to be employed as natural antimicrobial agents.
Keywords: Hemp, Probiotics, Pathogen, Biofilm
Downloads
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
References
Bag, A., and Chattopadhyay, R.R. (2017). Synergistic antibacterial and antibiofilm efficacy of nisin in combination with p–coumaric acid against food–borne bacteria Bacillus cereus and Salmonella typhimurium. Letters in Applied Microbiology 65(5): 366–372.
Ben, Y., Fu, C., Hu, M., Liu, L., Hung, M., and Zheng, C. (2019). Human health risk assessment of antibiotic resistance associated with antibiotic residues in the environment: A review. Environmental Research 169: 483–493.
Bonardi, S. (2017). Salmonella in the pork pro-duction chain and its impact on human health in the European Union. Epidemiology and Infection 145: 1513–1526.
BunpatanasaK, S., and Siriyota, K. (2019). Bacterial pathogens causing food poisoning in health region 2 and Phichit Province in 2013–2017. Journal of disease Prevention and Control 6: 1–15. (in Thai)
Clinical and Laboratory Standards Institute [CLSI]. (2009). Methods for Dilution Antimicrobial Susceptibility Test for Bacteria that Grow Aerobically; Approved Standard–Eighth Edition. CLSI Documents M07–A8. Wayne, PA: Clinical and Laboratory Standard Institute.
Elisha, I. L., Botha, F. S., McGaw, L. J., and Eloff, J. N. (2017). The antibacterial activity of extracts of nine plant species with good activity against Escherichia coli against five other bacteria and cytotoxicity of extracts. BMC Complementary and Alternative Medicine 17(1): 1–10.
Fogele, B., Granta, R., Valcina, O., and Berzinš, A. (2018). Occurrence and diversity of Bacillus cereus and moulds in spices and herbs. Food Control 83: 69–74.
Frassinetti, S., Gabriele, M., Moccia, E., Longo, V., and Di, D. (2020). Antimicrobial and antibiofilm activity of Cannabis sativa L. seeds extract against Staphylococcus aureus and growth effects on probiotic Lactobacillus. LWT – Food Science and Technology 124: 109149.
Hayrapetyan, H., Muller, L., Tempelaars, M., Abee, T., and Groot, M. N. (2015). Comparative analysis of biofilm formation by Bacillus cereus reference strains and undomesticated food isolates and the effect of free iron. International Journal of Food Microbiology 200: 72–79.
Kaur, S., Sharma, P., Kalia, N., Singh, J., and Kaur, S. (2018). Anti–biofilm properties of the fecal probiotic lactobacilli against Vibrio spp. Frontiers in Cellular and Infection Microbiology 8: 120.
Kim, N., Kim, W.J. and Kang, S. (2019). Anti–biofilm effect of crude bacteriocin derived from Lactobacillus brevis DF01 on Escherichia coli and Salmonella Typhimurium. Food Control 98: 274–280.
Lequette, Y., Boels, G., Clarisse, M., and Faille, C. (2010). Using enzymes to remove biofilms of bacterial isolates sampled in the food–industry. Biofouling 26: 421–431.
Manyi–Loh, C., Mamphweli, S., Meyer, E., and Okoh, A. (2018). Antibiotic use in agriculture and its consequential resistance in environmental sources: potential public health implications. Molecules 23(4): 1–48.
Nafis, A. Kasrati, A., Jamali, C. A., Mezrioui, N., Setzer, W. Abbad, A., and Hassani, L. (2019). Antioxidant activity and evidence for synergism of Cannabis sativa (L.) essential oil with antimicrobial standards. Industrial Crops and Products 137: 396–400.
Naveed, M., Khan, T.A., Ali, I., Hassan, A., Ali, H., Din, Z. U., Hassan, Z., Saqib, T. S., Majid, A., and Rehman, M.U. (2014). In vitro antibacterial activity of Cannabis sativa leaf extracts to some selective pathogenic bacterial strains. International Journal of Biosciences 4: 65–70.
Nissen, L., Zatta, A., Stefanini, I., Grandi, S., Sgorbati, B., Biavati, B., and Mo, A. (2010). Characterization and antimicrobial activity of essential oils of industrial hemp varieties (Cannabis sativa L.). Fitoterapia 81: 413–419.
Nonwachai, T., and Duangkaew, C. (2016). Effect of Thai herbs extracted on growth inhibition of Aeromonas hydrophila. Khon Kaen Agriculture Journal 44: 124–129.
Park, E. J., Hussain, M. S., Wei, S., Kwon, M., and Oh, D.H. (2019). Genotypic and phenotypic characteristics of biofilm formation of emetic toxin producing Bacillus cereus strains. Food Control 96: 527–534.
Pellati, F., Brighenti, V., Sperlea, J., Marchetti, L., Bertelli, D., and Benvenuti, S. (2018). New methods for the comprehensive analysis of bioactive compounds in Cannabis sativa L. (hemp). Molecules 23(10): 2639.
Reda, F. M. (2019). Antibacterial and anti–adhesive efficiency of Pediococcus acidilactici against foodborne biofilm producer Bacillus cereus attached on different food processing surfaces. Food Science and Biotechnology 28(3): 841–850.
Tayyab, M., and Shahwar, D. (2015). GCMS analysis of Cannabis sativa L. from four different areas of Pakistan. Egyptian Journal of Forensic Sciences 5(3): 114–125.
Tipsing, S., Tongpim, S., and Meidong, R. (2019). Screening of bacteriocin–producing Bacillus against fish pathogens from fermented foods and preliminary characterization of the bacteriocin. Journal of Research Unit on Science, Technology and Environment for Learning 10(1): 1–13. (in Thai)
Tsiraki, M. I., and Savvaidis, I. N. (2016). The effects of citrus extract (Citrox©) on the naturally occurring microflora and inoculated pathogens, Bacillus cereus and Salmonella enterica, in a model food system and the traditional Greek yogurt–based salad Tzatziki. Food Microbiology 53: 150–155.
Wang, B., Sain, M., and Oksman, K. (2007). Study of structural morphology of hemp fiber from the micro to the nanoscale. Applied Composite Materials 14: 89–103.