การศึกษาพยาธิสภาพต่อมย่อยอาหารของหอยเชอรี่ (Pomacea canaliculata) จากพื้นที่อาศัยซึ่งได้รับผลกระทบของมนุษย์ที่ต่างกันในจังหวัดชลบุรี
Main Article Content
Abstract
Krongthong Tangsitthi, Sasithorn Muncharoen, Amporn Tongkukiatkul and Chantima Piyapong
รับบทความ: 23 พฤษภาคม 2561; แก้ไขบทความ: 6 มีนาคม 2562; ยอมรับตีพิมพ์: 30 เมษายน 2562
บทคัดย่อ
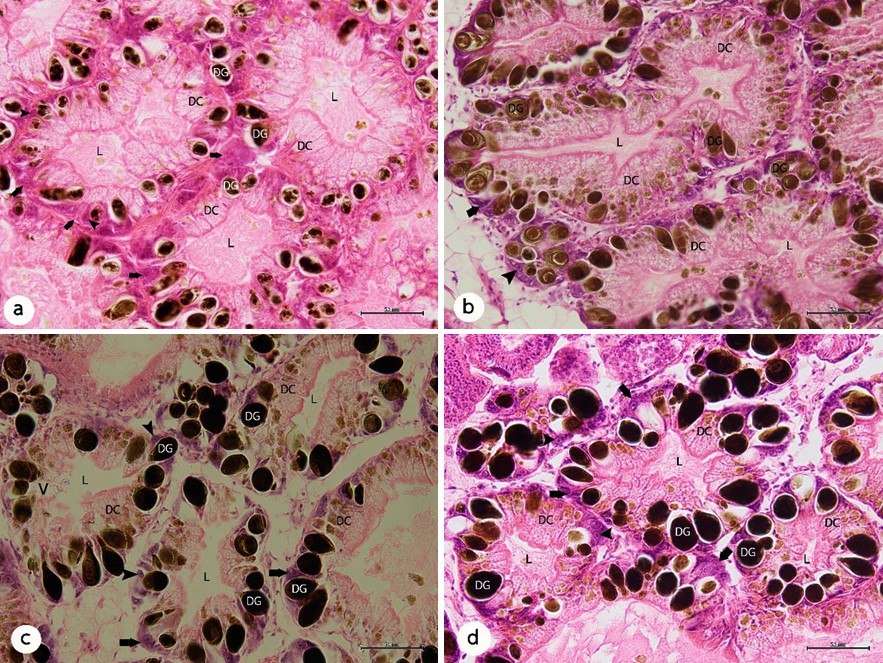
จังหวัดชลบุรีตั้งอยู่ในพื้นที่ภาคตะวันออกของประเทศไทยได้รับการกำหนดให้เป็นส่วนหนึ่งของพื้นที่เขตเศรษฐกิจพิเศษภาคตะวันออก ซึ่งการพัฒนานี้อาจส่งผลต่อคุณภาพน้ำจืดในจังหวัดชลบุรี การเปลี่ยนแปลงทางพยาธิสภาพเป็นตัวบ่งชี้ที่ดีของผลของมลพิษต่อสิ่งมีชีวิตที่ได้รับสารพิษและสามารถใช้เป็นเครื่องมือในการบ่งชี้เพื่อแสดงถึงความเป็นพิษในเบื้องต้นได้ ต่อมย่อยอาหารของหอยเป็นบริเวณที่สำคัญในการสะสมและการกำจัดสารพิษ ด้วยเหตุนี้การเปลี่ยนแปลงของต่อมย่อยอาหารของหอยจึงสามารถใช้เป็นตัวชี้วัดทางชีวภาพสำหรับการติดตามมลพิษทางสิ่งแวดล้อมได้ งานวิจัยนี้จึงศึกษาพยาธิสภาพต่อมย่อยอาหารของหอยเชอรี่ (Pomacea canaliculata) จากพื้นที่อาศัยในแหล่งน้ำจืดที่ต่างกันในจังหวัดชลบุรี ได้แก่ พื้นที่อ้างอิง (เป็นพื้นที่นอกเขตจังหวัดชลบุรี มีค่า DO อยู่ในช่วง 3.13–4.93 mg/L ซึ่งมีสภาพแวดล้อมของน้ำจืดค่อนข้างดี) พื้นที่ป่า พื้นที่เกษตรกรรมและพื้นที่ชุมชน ตลอดจนตรวจสอบคุณสมบัติทางพยาธิสภาพของหอยจากสิ่งแวดล้อมเหล่านี้ รวมทั้งคณะผู้วิจัยได้วัดตัวบ่งชี้ทางกายภาพพื้นฐานของคุณภาพน้ำด้วย จากการศึกษาทางเนื้อเยื่อวิทยาบริเวณต่อมย่อยอาหารของหอยเชอรี่จากพื้นที่อ้างอิง พบว่า ต่อมย่อยอาหารมีลักษณะเป็นท่อ ประ-กอบด้วยเซลล์ย่อยอาหารและเซลล์เบโซฟิลิก นอกจากนี้ยังพบแกรนูลสีเข้มกระจายอยู่ทั่วบริเวณต่อมย่อยอาหารด้วย โดยการเปลี่ยนแปลงทางพยาธิสภาพของต่อมย่อยอาหารที่เกิดจากสิ่งแวดล้อม ได้แก่ การเสียสภาพของเนื้อเยื่อบุผิว การลดลงของขนาดช่องว่างภายในท่อต่อมย่อยอาหารและพบการเพิ่มจำนวนของเซลล์เบโซฟิลิกและแกรนูลสีเข้ม จากผลการศึกษาพบว่าต่อมย่อยอาหารของหอยเชอรี่จากพื้นที่เกษตรกรรมมีการเสียสภาพของเนื้อเยื่อบุผิวอย่างชัดเจนเมื่อเปรียบเทียบกับพื้นที่อ้างอิง เนื่องจากการศึกษาครั้งนี้เป็นการศึกษาเบื้องต้นโดยมีจำนวนตัวอย่างน้อยและผลการศึกษานี้ยังไม่ชัดเจนว่าสามารถนำต่อมย่อยอาหารของหอยเชอรี่ไปใช้เป็นตัวชี้วัดทางชีวภาพสำหรับการติดตามคุณภาพน้ำในสิ่งแวดล้อมของจังหวัดชลบุรีได้ อย่างไรก็ตามคณะผู้วิจัยเสนอให้มีการศึกษาพยาธิสภาพต่อมย่อยอาหารของหอยชนิดนี้และหอยฝาเดียวน้ำจืดชนิดอื่นเพื่อใช้เป็นเครื่องมือสำหรับเป็นตัวชี้วัดคุณภาพน้ำในสภาพแวดล้อมน้ำจืดของพื้นที่จังหวัดชลบุรีและพื้นที่อื่นในประเทศไทย
คำสำคัญ: Pomacea canaliculata ต่อมย่อยอาหาร พยาธิสภาพ ตัวชี้วัดทางชีวภาพ การติดตาม
Abstract
Chonburi Province in eastern Thailand has been designated part of the Eastern Economic Corridor (EEC). This development might affect freshwater quality in Chonburi Province. Histopathological alteration is a good indicator of the effects of pollution on exposed organisms and provides an early indication of toxicity. The digestive gland of molluscs is the major site of pollutant accumulation and detoxification. Therefore, digestive gland alteration of molluscs can be used as a biomarker for monitoring environmental pollution. The present study investi-gated the histopathology of the digestive gland of the golden apple snail (Pomacea canali-culata) from different freshwater habitats in Chonburi Province. This included: a reference site (occurring outwith Chonburi Province and with a DO range of 3.13–4.93 mg/L, i.e., a putatively ‘good’ freshwater environment), a forest site, an agricultural site, and an urban site. To examine histopathological properties of snails from these environments, we also measured some basic abiotic indicators of water quality. The histological study revealed that the digestive gland of the snail from the reference site was characterized by tubules composed of digestive and basophilic cells. In addition, we found dark granules scattered throughout the digestive glands. Environmentally–induced histopathological alterations to the digestive glands were indicated by degeneration of epithelium, a decreased lumen space in the digestive tubules and an increase in the number of basophilic cells and dark granules. The result revealed that the digestive glands of P. canaliculata from the agricultural site showed particular degeneration of the epithelium when compared with the reference site. Due to low sample sizes, the present study is preliminary and it is not absolutely clear whether the digestive gland of P. canaliculata can be used as a biomarker for monitoring water quality in the aquatic environment. However, we encourage histopathological examination of the digestive gland of this and other freshwater gastropods as a promising tool to monitor water quality in the aquatic environment of Chonburi Province and elsewhere in Thailand.
Keywords: Pomacea canaliculata, Digestive gland, Histopathology, Biomarker, Monitoring
Downloads
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
References
Abdel–Halim, K. Y., El–Saad, A. A., Talha, M. M., Hussein, A. A., and Bakry, N. M. (2013). Oxidative stress on land snail Helix aspersa as a sentinel organism for ecotoxicological effects of urban pollution with heavy metals. Chemosphere 93(6): 1131–1138.
Arrighetti, F., Ambrosio, E., Astiz, M., Capítulo, A. R., and Lavarías, S. (2018). Differential response between histological and biochemical biomarkers in the apple snail Pomacea canaliculata (Gasteropoda: Amullariidae) exposed to cypermethrin. Aquatic Toxicology 194: 140–151.
Auffret, M. (1988). Histopathological changes related to chemical contamination in Mytilus edulis from field and experimental conditions. Marine Ecology Progress Series 46: 101–107.
Bancroft, J. D., and Gamble, M. (Eds.). (2008). Theory and Practice of Histological Techniques. USA: Elsevier Health Sciences.
Bhagat, J., Ingole, B. S., and Singh, N. (2016). Glutathione S–transferase, catalase, super oxide dismutase, glutathione peroxidase, and lipid peroxidation as biomarkers of oxidative stress in snails: A review. Invertebrate Survival Journal 13: 336–349.
Chaichana, R., and Sumpan, T. (2015). Environmental tolerance of invasive golden apple snails (Pomacea canaliculata (Lamarck, 1822)) and Thai native apple snails (Pila scutata, (Mousson, 1848)). Tropical Ecology 56(3): 347–355.
Dummee, V., Kruatrachue, M., Trinachartvanit, W., Tanhan, P., Pokethitiyook, P., and Damrongphol, P. (2012). Bioaccumulation of heavy metals in water, sediments, aquatic plant and histopathological effects on the golden apple snail in Beung Boraphet reservoir, Thailand. Ecotoxicology and Environmental Safety 86: 204–212.
Dummee, V., Tanhan, P., Kruatrachue, M., Damrongphol, P., and Pokethitiyook, P. (2015). Histopathological changes in snail, Pomacea canaliculata, exposed to sublethal copper sulfate concentrations. Ecotoxicology and Environmental Safety 122: 290–295.
Eastern Economic Corridor Office. (2017). Retrieved from http://www.eeco.or.th/en/-back ground, December 14, 2017.
Halwart, M. (1994). The golden apple snail Pomacea canaliculata in Asian rice farming systems: Present impact and future threat. International Journal of Pest Management 40(2): 199–206.
Hamlet, S. A., Bensoltane, S., Djekoun, M., Yassi, F., and Berrebbah, H. (2012). Histological changes and biochemical para-meters in the hepatopancreas of terrestrial gastropod Helix aspersa as biomarkers of neonicotinoid insecticide exposure. African Journal of Biotechnology 11(96): 16277–16283.
Kanapala, V. K., and Arasada, S. P. (2013). Histopathological effect of paraquat (Gramoxone) on the digestive gland of freshwater snail Lymnaea luteola (Lamarck: 1799) (Mollusca: Gastropoda). International Journal of Scientific Research in Environmental Sciences 1(9): 224.
Klobucar, G. I., Lajtner, J., and Erben, R. (2001). Increase in number and size of kidney concretions as a result of PCP exposure in the freshwater snail Planorbarius corneus (Gastropoda, Pulmonata). Diseases of aquatic organisms 44(2): 149–154.
Kruatrachue, M., Sumritdee, C., Pokethitiyook, P., and Singhakaew, S. (2011). Histopathological effects of contaminated sedi-ments on golden apple snail (Pomacea canaliculata, Lamarck 1822). Bulletin of Environmental Contamination and Toxicology 86(6): 610.
Lowe, D. M. (1988). Alterations in cellular structure of Mytilus edulis resulting from exposure to environmental contaminants under field and experimental conditions. Marine Ecology Progress Series 46: 91–100.
Marigómez, I., Soto, M., Cajaraville, M. P., Angulo, E., and Giamberini, L. (2002). Cellular and subcellular distribution of metals in molluscs. Microscopy Research and Technique 56(5): 358–392.
Mason, A. Z., and Simkiss, K. (1982). Sites of mineral deposition in metal–accumulating cells. Experimental Cell Research 139(2): 383–391.
Mleiki, A., Zaldibar, B., Izagirre, U., El Menif, N. T., and Marigómez, I. (2018). Effects of dietary Pb and Cd and their combi-nation on lysosomal and tissue–level biomarkers and histopathology in digestive gland of the land snail, Cantareus aper-tus (Born, 1778). Ecotoxicology and Environmental safety 156: 301–310.
Mochida, O. (1991). Spread of freshwater Pomacea snails (Pilidae, Mollusca) from Argentina to Asia. Micronesica (3, Supplement): 51–62.
Moëzzi, F., Javanshir, A., Eagderi, S., and Poorbagher, H. (2013). Histopathological effects of zinc (Zn) on mantle, digestive gland and foot in freshwater mussel, Anodonta cygnea (Linea, 1876). International Journal of Aquatic Biology 1(2): 61–67.
Naylor, R. (1996). Invasions in agriculture: assessing the cost of the golden apple snail in Asia. Ambio 25(7): 443–448.
Neff, J. M., Hillman, R. E., Carr, R. S., Buhl, R. L., and Lahey, J. I. (1987). Histopathological and biochemical responses in arctic marine bivalve molluscs exposed to experimentally spilled oil. Arctic 40(Suppl.1): 220–229.
Osterauer, R., Köhler, H. R., and Triebskorn, R. (2010). Histopathological alterations and induction of hsp70 in ramshorn snail (Marisa cornuarietis) and zebrafish (Danio rerio) embryos after exposure to PtCl2. Aquatic Toxicology 99(1): 100–107.
Palmeirim, M., Bordes, F., Chaisiri, K., Siribat, P., Ribas, A., and Morand, S. (2014). Helminth parasite species richness in rodents from Southeast Asia: role of host species and habitat. Parasitology Research 113 (10): 3713–3726.
Papadopulos, F., Spinelli, M., Valente, S., Foroni, L., Orrico, C., Alviano, F., and Pasquinelli, G. (2007). Common tasks in microscopic and ultrastructural Image analysis using ImageJ. Ultrastructural Pathology 31(6): 401–407.
Pollution Control Department. (2010). Pro-cedures for collecting water samples from a water source. Retrieved from http://www.pcd.go.th/public/Publications/print_water.cfm?task=Water_CollNat_Manual, December 25, 2017.
Radwan, M. A., El–Gendy, K. S., and Gad, A. F. (2010). Oxidative stress biomarkers in the digestive gland of Theba pisana ex-posed to heavy metals. Archives of Environmental contamination and Toxicology 58(3): 828–835.
Radwan, M. A., Essawy, A. E., Abdelmeguied, N. E., Hamed, S. S., and Ahmed, A. E. (2008). Biochemical and histochemical studies on the digestive gland of Eobania vermiculata snails treated with carbamate pesticides. Pesticide biochemistry and Physiology 90(3): 154–167.
Sawasdee, B., Köhler, H. R., and Triebskorn, R. (2011). Histopathological effects of copper and lithium in the ramshorn snail, Marisa cornuarietis (Gastropoda, Prosobranchia). Chemosphere 85(6): 1033–1039.
Sharaf, H. M., and Shehata, A. M. (2015). Heavy metals and hydrocarbon concentrations in water, sediments and tissue of Cyclope neritea from two sites in Suez Canal, Egypt and histopathological effects. Journal of Environmental Health Science and Engineering 13(1): 14.
Sharaf, H. M., Salama, M. A., and Abd El–Atti, M. S. (2015). Biochemical and histological alterations in the digestive gland of the land snail Helicella vestalis (Locard, 1882) exposed to methiocarb and chlorpyrifos in the laboratory. International Journal Science Research 4: 334–343.
Sreeram, M. P., and Menon, N. R. (2005). Histopathological changes in the heaptopancreas of the penaeid shrimp Metapenaeus dobsoni exposed to petroleum hydrocarbons. Journal of the Marine Biological Association of India 47(2): 160–168.
Thaewnon–Ngiw, B., Klinbunga, S., Phanwichien, K., Sangduen, N., Lauhachinda, N., and Menasveta, P. (2004). Genetic diversity and molecular markers in introduced and Thai native apple snails (Pomacea and Pila). BMB Reports 37(4): 493–502.
Usheva, L. N., Vaschenko, M. A., and Durkina, V. B. (2006). Histopathology of the digestive gland of the bivalve mollusk Crenomytilus grayanus (Dunker, 1853) from southwestern Peter the Great Bay, Sea of Japan. Russian Journal of Marine Biology 32(3): 166–172.
Vasanthi, L. A., Revathi, P., Arulvasu, C., and Munuswamy, N. (2012). Biomarkers of metal toxicity and histology of Perna viridis from Ennore estuary, Chennai, south east coast of India. Ecotoxicology and Environmental Safety 84: 92–98.
Wedderburn, J., McFadzen, I., Sanger, R. C., Beesley, A., Heath, C., Hornsby, M., and Lowe, D. (2000). The field application of cellular and physiological biomarkers, in the mussel Mytilus edulis, in conjunction with early life stage bioassays and adult histopathology. Marine Pollution Bulletin 40(3): 257–267.
Wilcock, R. J., McBride, G. B., Nagels, J. W., and Northcott, G. L. (1995). Water quality in a polluted lowland stream with chronically depressed dissolved oxygen: causes and effects. New Zealand Journal of Marine and Freshwater Research 29(2): 277–288.